治験とは
治験とは
「治験」とは、新しいお薬の有効性(効果)や安全性(副作用)などの確認をして、医薬品として製造・販売の許可を得るために行われる「臨床試験」のことです。
「臨床試験」とは、人での有効性や安全性を確認するための試験を指します。「臨床試験」の中でも特に新しいお薬を開発するための「臨床試験」を「治験」と呼んでいます。
「臨床試験」とは、人での有効性や安全性を確認するための試験を指します。「臨床試験」の中でも特に新しいお薬を開発するための「臨床試験」を「治験」と呼んでいます。
新薬開発のながれ
まず自然界にある物質や化学合成された物質より「くすりの候補物質」を探します。次に動物でその物質の効果や毒性についての試験(「非臨床試験」)を実施し、その効果や毒性の程度を確認してから、「治験」に進みます。
「治験」の段階は、大きく以下の3つに分かれています。
第Ⅰ相
| 少数の健康成人を対象に安全性、薬物動態を確認する試験
|
第Ⅱ相
| 少数の患者さんを対象に安全性、有効性の確認及び用量を設定する試験
|
第Ⅲ相
| 多数の患者さんを対象に安全性、有効性の確認、適応疾患における用法・用量を確認する試験
|
上記の「治験」において良好な結果が得られた場合は、国(厚生労働省)に申請を行います。国は厳重な審査を行い、その結果承認されると新薬として発売されることになります。
GCPとは
治験は、厚生労働省が定めるルール「医薬品の臨床試験に関する基準(GCP:Good Clinical Practice)」に従って実施しています。
「GCP」とは、医薬品を製造・販売するための承認を申請する際に提出する資料の遵守事項や治験に参加する人の人権・安全が守られていることや治験の科学的な質と成績の信頼性を確保することを目的として定められたものです。
「GCP」とは、医薬品を製造・販売するための承認を申請する際に提出する資料の遵守事項や治験に参加する人の人権・安全が守られていることや治験の科学的な質と成績の信頼性を確保することを目的として定められたものです。
IRBとは
治験実施に先立って「治験審査委員会(IRB:Institutional Review Board)」により審査する必要があります。
「IRB」とは、医療機関や治験を依頼した者から独立した委員会で、治験に参加する人の人権・安全が保護されているか審査する委員会です。
「IRB」とは、医療機関や治験を依頼した者から独立した委員会で、治験に参加する人の人権・安全が保護されているか審査する委員会です。
臨床研究とは
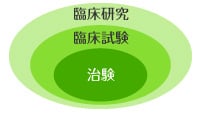
「臨床研究」とは、人を対象として病気の予防、診断方法、治療方法の開発や病気の原因やしくみを知るために行われる医学研究のことです。「臨床試験」と比べ、「非臨床試験」や「疫学研究」が含まれます。

